Автор:
Eugene Taylor
Дата Створення:
12 Серпень 2021
Дата Оновлення:
22 Червень 2024
Зміст
- Крок
- Частина 1 з 2: Нормальна електронна конфігурація елемента
- Частина 2 з 2: Електронна конфігурація благородного газу
- Попередження
Запис електронної конфігурації для елемента - це хороший спосіб поглянути на розподіл електронів в атомі. Залежно від елемента, формула може бути дуже довгою. Тому вчені розробили скорочення, яке використовує благородний газ для представлення електронів, що не є валентними електронами. Це спрощує електронну конфігурацію і полегшує розуміння хімічних властивостей елемента.
Крок
Частина 1 з 2: Нормальна електронна конфігурація елемента
 Визначте кількість електронів, присутніх в елементі. Атомний номер елемента повідомляє вам кількість протонів, які він має. Оскільки елементи у своєму нейтральному стані мають однакову кількість протонів та електронів, ви також можете використовувати атомний номер як кількість електронів, що є в елементі. Атомний номер, який ви можете знайти в таблиці Менделєєва, - це число безпосередньо над символом елемента.
Визначте кількість електронів, присутніх в елементі. Атомний номер елемента повідомляє вам кількість протонів, які він має. Оскільки елементи у своєму нейтральному стані мають однакову кількість протонів та електронів, ви також можете використовувати атомний номер як кількість електронів, що є в елементі. Атомний номер, який ви можете знайти в таблиці Менделєєва, - це число безпосередньо над символом елемента. - Наприклад, символом натрію є Na. Атомний номер Na становить 11.
 Знання про електронні оболонки та рівні енергії. Перша електронна оболонка має лише енергетичний рівень s, друга електронна оболонка має енергетичний рівень s і p. Третя електронна оболонка має енергетичний рівень s, p і d. Четверта електронна оболонка має енергетичний рівень s, p, d і f. Є більше чотирьох електронних оболонок, але в середній хімічній школі ви, як правило, стикаєтесь лише з першими чотирма.
Знання про електронні оболонки та рівні енергії. Перша електронна оболонка має лише енергетичний рівень s, друга електронна оболонка має енергетичний рівень s і p. Третя електронна оболонка має енергетичний рівень s, p і d. Четверта електронна оболонка має енергетичний рівень s, p, d і f. Є більше чотирьох електронних оболонок, але в середній хімічній школі ви, як правило, стикаєтесь лише з першими чотирма. - Кожен енергетичний рівень s може містити до 2 електронів.
- Кожен р енергетичного рівня може містити до 6 електронів.
- Кожен d енергетичний рівень може містити до 10 електронів.
- Кожен рівень енергії f може містити до 14 електронів.
 Вивчіть правила заповнення електронів. Відповідно до принципу Ауфбау, ви повинні додати електрони до найнижчих енергетичних рівнів, перш ніж електрон можна додати до більш високого енергетичного рівня. Кожен енергетичний рівень може мати кілька суборбіталів, але кожен суборбіталь може одночасно вміщувати до двох електронів. Енергетичний рівень s має один суборбітал, p має 3 суборбіталі, d має 5 суборбіталів, а f має 7 суборбіталів.
Вивчіть правила заповнення електронів. Відповідно до принципу Ауфбау, ви повинні додати електрони до найнижчих енергетичних рівнів, перш ніж електрон можна додати до більш високого енергетичного рівня. Кожен енергетичний рівень може мати кілька суборбіталів, але кожен суборбіталь може одночасно вміщувати до двох електронів. Енергетичний рівень s має один суборбітал, p має 3 суборбіталі, d має 5 суборбіталів, а f має 7 суборбіталів. - Рівень енергії d має трохи вищу енергію, ніж нижчий рівень енергії електронної оболонки, тому вищий рівень енергії s, швидше за все, заповнюється, ніж нижчий рівень енергії d. Для написання електронної конфігурації це означає, що вона буде виглядати так: 1s2s2p3s3p4s3d.
 Використовуйте графік діагональної конфігурації для запису електронних конфігурацій. Найпростіший спосіб запам'ятати, як заповнюються електрони, - це скористатися схемою конфігурації. У цьому ви записуєте кожну оболонку та рівні енергії. Намалюйте діагональні лінії від верхнього правого до нижнього лівого кута кожного рядка. Схема конфігурації така:
Використовуйте графік діагональної конфігурації для запису електронних конфігурацій. Найпростіший спосіб запам'ятати, як заповнюються електрони, - це скористатися схемою конфігурації. У цьому ви записуєте кожну оболонку та рівні енергії. Намалюйте діагональні лінії від верхнього правого до нижнього лівого кута кожного рядка. Схема конфігурації така: - 1с
2с 2р
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6с 6р 6д
7с 7с - Наприклад: Електронна конфігурація натрію (11 електронів): 1s2s2p3s.
- 1с
 Визначте останню орбіталу кожної конфігурації. Переглядаючи періодичну таблицю, ви можете визначити, якою буде остання підшелупка та останній енергетичний рівень електронної конфігурації. Спочатку визначте, в який блок потрапляє елемент (s, p, d або f). Потім підрахуйте, в якому рядку знаходиться елемент. Нарешті, порахуйте, в якому стовпці знаходиться елемент.
Визначте останню орбіталу кожної конфігурації. Переглядаючи періодичну таблицю, ви можете визначити, якою буде остання підшелупка та останній енергетичний рівень електронної конфігурації. Спочатку визначте, в який блок потрапляє елемент (s, p, d або f). Потім підрахуйте, в якому рядку знаходиться елемент. Нарешті, порахуйте, в якому стовпці знаходиться елемент. - Наприклад, натрій знаходиться в блоці s, тому остання орбіталя його електронної конфігурації - s. Це в третьому рядку та першому стовпці, тому остання орбіталя - 3s. Це хороший спосіб перевірити остаточну відповідь.
- Правило дещо відрізняється для d-орбіталі. Перший рядок елементів d-блоку починається з четвертого рядка, але вам потрібно відняти 1 з номера рядка, оскільки рівні s мають меншу енергію, ніж рівні d. Наприклад: ванадій закінчується на 3d.
- Інший спосіб перевірити свою роботу - це скласти всі індекси. Вони повинні дорівнювати кількості електронів в елементі. Якщо у вас занадто мало або занадто багато електронів, вам слід переглянути свою роботу і спробувати ще раз.
Частина 2 з 2: Електронна конфігурація благородного газу
 Визначте електронну конфігурацію благородного газу. Електронна конфігурація благородного газу - це свого роду скорочений спосіб виписати повну електронну конфігурацію елемента. Стенографія благородного газу використовується для узагальнення електронної конфігурації елемента, забезпечуючи при цьому найбільш актуальну інформацію про валентні електрони цього елемента.
Визначте електронну конфігурацію благородного газу. Електронна конфігурація благородного газу - це свого роду скорочений спосіб виписати повну електронну конфігурацію елемента. Стенографія благородного газу використовується для узагальнення електронної конфігурації елемента, забезпечуючи при цьому найбільш актуальну інформацію про валентні електрони цього елемента. - Благородний газ заміщений для представлення всіх електронів, які не є валентними електронами.
- Благородними газами є гелій, неон, аргон, криптон, ксенон і радон і знаходяться в останній колонці періодичної таблиці.
 Визначте благородний газ у періоді для вашого елемента. Період елемента - це горизонтальний рядок, в якому розташований елемент. Якщо елемент знаходиться в четвертому рядку періодичної таблиці, це в періоді чотири. Благородний газ, яким ви будете користуватися, знаходиться в третьому періоді. Нижче наведено перелік благородних газів та їх періоди:
Визначте благородний газ у періоді для вашого елемента. Період елемента - це горизонтальний рядок, в якому розташований елемент. Якщо елемент знаходиться в четвертому рядку періодичної таблиці, це в періоді чотири. Благородний газ, яким ви будете користуватися, знаходиться в третьому періоді. Нижче наведено перелік благородних газів та їх періоди: - 1: Гелій
- 2: Неон
- 3: Аргон
- 4: Криптон
- 5: ксенон
- 6: Радон
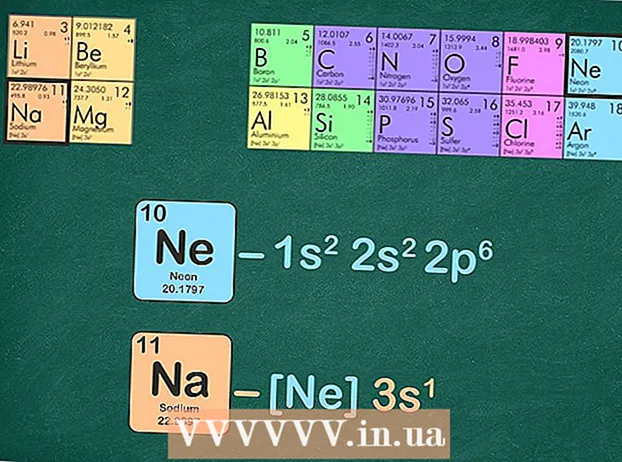
- Наприклад, натрій знаходиться в періоді 3. Ми будемо використовувати неон для конфігурації благородного газу, оскільки він знаходиться в періоді 2.
 Замініть благородний газ на ту саму кількість електронів, яку має благородний газ. Є кілька способів зробити це наступним кроком. Ви можете записати електронну конфігурацію благородного газу, а потім замінити ту саму конфігурацію в елементі, який вас цікавить. Альтернативою є видалення тієї самої кількості електронів, яку має благородний газ, з елемента, для якого ви пишете конфігурацію.
Замініть благородний газ на ту саму кількість електронів, яку має благородний газ. Є кілька способів зробити це наступним кроком. Ви можете записати електронну конфігурацію благородного газу, а потім замінити ту саму конфігурацію в елементі, який вас цікавить. Альтернативою є видалення тієї самої кількості електронів, яку має благородний газ, з елемента, для якого ви пишете конфігурацію. - Наприклад, натрій має 11 електронів, а неон - 10 електронів.
- Повна електронна конфігурація натрію становить: 1s22p3s, а неон - 1s22p. Як бачите, натрій має 3s, а неон - ні, тому конфігурація благородного газу для натрію стає [Ne] 3s.
- Крім того, ви можете рахувати індекси рівнів енергії, поки не отримаєте десять. Видаліть ці рівні енергії і не кажучи вже про те, що залишилось. Якщо ви використовуєте неон для написання електронної конфігурації натрію, у вас залишиться один електрон: [Ne] 3s.
Попередження
- Тільки в нейтральному атомі атомний номер дорівнює кількості електронів. Іон містить різну кількість електронів. Якщо іон має заряд -1, він має один зайвий електрон. Заряд -2 має два зайвих електрони тощо.